Mecanismo de reparación
Qué heredamos de papá
El estudio de qué aporta cada progenitor a la descendencia se ha centrado en los últimos años en el legado masculino. Y en las marcas epigenéticas que transmiten malformaciones durante generaciones. Es la hora de establecer las herramientas para revertir las malformaciones

El debate sobre qué aporta cada uno de los progenitores a la descendencia es antiguo, y los avances en reproducción asistida a lo largo del siglo XX pusieron el foco sobre todo en los factores maternos, por considerar que en las primeras fases de reproducción el papel masculino era menos relevante. Desde principios de este siglo se ha vuelto la vista a la importancia de la información genética de los espermatozoides desde las primeras etapas de desarrollo; y en cómo los daños que podrían presentarse (muchos de ellos por contaminación por factores medioambientales) se transmiten a la descendencia durante generaciones, a través de las alteraciones de las marcas epigenéticas.
Ahora que se conocen los mecanismos que producen estos efectos, es la hora de investigar en cómo revertir las alteraciones del desarrollo embrionario y desarrollar las tecnologías y biotecnologías útiles para aplicar estos descubrimientos. Uno de ellos, la aplicación de un compuesto del té verde que interfiere el proceso químico que da lugar a las malformaciones.
La investigación se centra ahora en descifrar los mecanismos de reparación de las alteraciones que provocan esas malformaciones, para aplicar la tecnología necesaria. Las investigaciones en todo el proceso se han llevado a cabo con peces cebra, como modelos de laboratorio; pero se trabaja ya en células de rata y con semen humano.
Cierto nivel de daño del espermatozoide puede ser reparado por el ovocito, si no es así afectará al desarrollo
Toda esta trayectoria investigadora ha llevado a cabo el grupo que desde hace años dirige Paz Herráez Ortega, catedrática de Biología Celular en el Departamento de Biología Molecular de la Universidad de León, que lleva más de 25 años trabajando en el campo de la reproducción masculina. Herráez, que tiene una amplia trayectoria como investigadora también en prestigiosos centros extranjeros, desarrolla su labor como docente en los grados de Biotecnología y Biología, y en los másteres de Biología Fundamental, Biomedicina y Veterinaria. La catedrática hace hincapié en el trabajo conjunto con los becarios, ya que ha dirigido once tesis, diez de ellas en el campo de la reproducción. Señala especialmente la contribución de las doctoras Cristina Fernández, Silvia González y Marta Lombó, «que han trabajado conmigo durante los últimos 7 años, y con el desarrollo de sus tesis han realizado gran parte este trabajo».
En sus comienzos como investigadora en la Universidad de León Paz Herráez trabajó en el grupo de Investigación de Técnicas de Reproducción Asistida (Itra); y después en el Grupo Modcell, cuando su interés se centró en la contribución paterna en la reproducción. Destaca también la importancia de la colaboración con las redes europeas de investigación, y la aportación de los intercambios de investigadores. Han participado en redes como Aquagamete y Epiconcept.
A la hora de explicar la evolución que ha seguido la investigación desarrollada por el equipo señala que «cada uno de los parentales aporta la mitad de los cromosomas para formar el cigoto, que se dividirá para formar el embrión. Los cromosomas proceden de ambos progenitores. Estos conocimientos son relativamente recientes, y siempre se ha debatido qué aportaba cada uno de los progenitores».
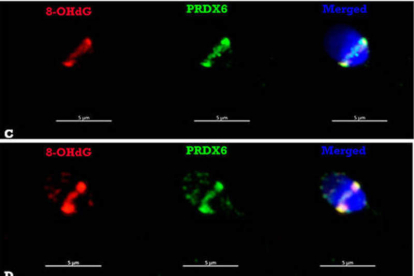
Núcleos de espermatozoides humanos con daño genético. DL
En lo que se refiere al óvulo, su «material genético contiene toda la información necesaria para formar cualquier proteína, pero necesita un paso intermedio en el que la información se simplifica para formar lo que llamamos los transcritos, que después serán el molde para fabricar las proteínas».
El espermatoziode se genera de forma distinta, especializándose en moverse rápidamente, y el ADN está muy empaquetado dentro de su núcleo. «Es difícil de leer, al contrario que en el óvulo».
Herráez señala que durante el siglo pasado «se hicieron grandes avances en las tecnologías de reproducción asistida, con el foco en los factores maternos. El papel masculino en esas primeras fases de la reproducción parecía francamente prescindible. Eso se veía avalado por aspectos como que las primeras fases del desarrollo, en el que se van fabricando células del nuevo embrión, parecen independientes del espermatozoide, podrían hacerse sólo con la información del óvulo».
Sin embargo, la información que contiene el espermatozoide adquiere importancia en el momento en el que se «leen las instrucciones genéticas» para desarrollar el cigoto.
La epigenética, que altera la forma en la que se descifra el mensaje genético, es sensible a factores ambientales
«De hecho, anteriormente, cuando se analizaba la calidad seminal se centraba sólo en parámetros que tenían que ver con su capacidad para llegar hasta el óvulo y fecundarlo. No fue hasta principios del siglo XXI cuando se empezó a poner atención en la información genética que lleva el espermatozoide desde el primer momento de desarrollo. Porque se vio que cuando se hacían estas técnicas en espermatozoides que tenían algún tipo de daño extra en el genoma aumentaba la tasa de abortos e incluso los problemas a largo plazo en la descendencia. A partir de ahí se asumió que el estudio del genoma espermático era esencial para los problemas de infertilidad».
La catedrática de Biología Celular destaca que «la formación de espermatozoides es un proceso largo, y durante ese camino el genoma se va preparando, y ese proceso ya facilita que sufra roturas. Además, se pierde mucho material extra de la célula, de forma que todas las herramientas que ésta tiene para reparar los daños del genoma se van perdiendo».
De esta manera, durante la espermatogénesis, los espermatozoides van añadiendo daño fisiológico a su genoma. «A ese daño se le puede sumar el producido por los agentes externos, desde los tóxicos a los que esté sometido de medicamentos, tabaco, etc. a radiación, efectos de temperatura, congelación del semen,...».
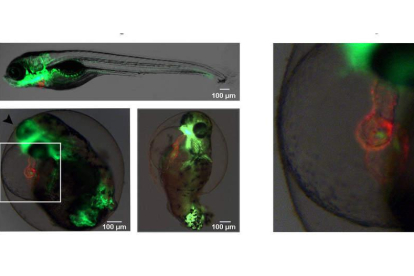
Imágenes de un pez cebra normal, y otros tratados con Bisfenol A que tienen malformaciones cardíacas. DL
Muchos de esos daños son reparados por el ovocito después de la fecundación. «Pero ¿cuáles son las consecuencias de este proceso? Cierto nivel de daño es lógico, pero las consecuencias serán distintas según el grado. El ovocito es capaz de reparar un daño menor y el desarrollo sigue normalmente; pero si el daño es algo mayor suele ocurrir un momento de parada, antes de decidir si seguir adelante. Y, si el daño es muy alto, las células se suicidan, es el mecanismo de apoptosis, que impide el desarrollo del embrión».
Este proceso se daría en una evolución normal del desarrollo, pero «también puede ocurrir que estos mecanismos no funcionen, y el desarrollo progrese sin reparación, lo que da lugar a problemas en la salud fetal».
«¿Hasta qué punto puede el ovocito reparar el daño del espermatozoide que llega? Es difícil de calcular, la trucha es capaz de hacerlo hasta un 10% del daño que viene del espermatozoide, en humanos hay hasta un 30%, pero es muy variable. Y las consecuencias que puede acarrear son muy variadas, desde obesidad a envejecimiento prematuro, u otro tipo de malformaciones, según hemos comprobado en los experimentos que se han llevado a cabo a lo largo de estos años».
Las malformaciones provocadas por tóxicos se transmiten a la descendencia a lo largo de varias generaciones
En el caso de los peces, con los que el grupo de investigación ha llevado a cabo la mayor parte de sus investigaciones, «observamos que la tasa de malformaciones era muchísimo más alta, parecía que no se detenía el desarrollo a pesar de los daños en el embrión. Nosotros provocábamos daños en el espermatozoide, se fecundaban los ovocitos y analizábamos qué ocurría».
En las tesis que se han realizado en el grupo Modcell «vimos que en los peces, cuando se fecundaba con espermatozoides dañados, en las primeras fases había una gran intensificación de los procesos de reparación, pero si esa reparación no ocurría correctamente, el embrión continuaba adelante con su desarrollo. Y eso determinaba la formación de los huesos, el corazón,... Curiosamente en los peces, cuando no se podía llevar a cabo la reparación, en lugar de parar el desarrollo y empezar con la apoptosis, la inhibían y desarrollaban una gran tolerancia al daño genético».

Paz Herráez, en su laboratorio. JESÚS F. SALVADORES
Esto, señala Herráez, «es algo que no cabía en la lógica que teníamos hasta ese momento. Pero hay que tener en cuenta que la estrategia reproductiva de los mamíferos y de los peces no es la misma. Un mamífero invierte mucha energía en generar muy pocos embriones, y controla hasta el máximo su desarrollo, de manera que no permite alteraciones; mientras que la estrategia de los peces es generar muchos descendientes que puedan enfrentarse a un ambiente muy cambiante, y que van a soportar una tasa de mortalidad muy alta. Quizá en esas condiciones haya alguna variante que les haga más resistentes. Es decir, tolerar ese daño genético puede ser un mecanismo evolutivo».
Los avances en las investigaciones incluyeron también, en los últimos años, los cambios que se producen en la lectura del ADN a través de procesos químicos: la epigenética. Estos cambios no alteran la secuencia de ADN y son heredables. «Las marcas epigenéticas nos indican cómo leer los códigos del ADN. El espermatozoide tiene sus propias marcas, que han de ser conservadas para lograr el desarrollo embrionario. Esas marcas tienen una particularidad, y es que son sensibles al ambiente, y cambian en función de las condiciones. Se mantienen en el tiempo y afectan al desarrollo».
Alteraciones
Las investigaciones del equipo de Herráez se han centrado en ver si esas alteraciones que se producen a través de los espermatozoides se transmiten a través de varias generaciones. Buena parte de los experimentos se han realizado con el EE2, una hormona que aparece en el agua como contaminante, en buena parte procede de medicamentos hormonales. Cuando exponíamos a los padres a distintas concentraciones de este tóxico, y los cruzábamos con hembras que habían estado en agua normal, teníamos distintos tipos de malformaciones esqueléticas, edemas,... Y no sólo malformaciones físicas, sino distinto comportamiento: los hijos de padres tratados se mueven mucho menos, o son estáticos».
Los estudios sobre la influencia de la contaminación y las marcas epigenéticas que produce se han llevado a cabo también con Bisfenol A, un producto presente en determinados plásticos y materiales muy presentes en la vida diaria. «Estamos continuamente expuestos a ellos, y aparecen también en aguas contaminadas en concentraciones elevadas».
Las marcas epigenéticas pueden ser revertidas también a través de cambios y procesos ambientales
Durante la investigación se trató a machos adultos con Bisfenol y se les cruzó después con hembras sanas. «No nos importaban las consecuencias de la primera generación, sino de la segunda. Queríamos saber qué pasaba con los nietos de los machos tratados, para ver si los efectos se convertían en una herencia transgeneracional». El resultado de estos estudios fue muy novedoso, de hecho tuvo gran repercusión en publicaciones internacionales. «Se evidenció que ante concentraciones altas de Bisfenol, que ya está prohibido en algunos países, las malformaciones no sólo afectaban a la primera generación sino a las siguientes».
Paz Herráez destaca que «la buena noticia es que las marcas epigenéticas son sensibles al ambiente, son plásticas. Así, igual que algunos cambios ambientales pueden interferir en el desarrollo, otro cambio ambiental quizá pueda revertirlo. Y en eso se centra nuestro interés y trabajo actual. Una vez conocido cuál es el mecanismo que produce estas alteraciones, qué podemos hacer para revertirlo».
La investigación actual desarrolla el proceso por el cual «inhibiendo la producción de estos cambios somos capaces de revertir las alteraciones que se producen. De tal manera que estudios que parecen básicos sobre cómo funcionan las cosas te dan la aplicabilidad, la clave de cómo puedes modificar los mecanismos, y crear una biotecnología sobre ese conocimiento que permita superar un problema».
La investigación se centra actualmente en los mecanismos de reparación y las aplicaciones que pueden obtenerse
La catedrática destaca que cuando se descubren «los mecanismos fundamentales que están detrás de un proceso es cuando podemos desarrollar una tecnología útil. Las propuestas en las que trabajamos ahora nos ayudan a detoxificar. Vimos cómo es el mecanismo que hace que los efectos del tóxico se vayan propagando a través del esperma a las siguientes generaciones, y cuando descubrimos que es porque se añaden esas marcas epigenéticas sobre el genoma, a través de una reacción química, buscamos algún compuesto que fuera capaz de inhibir esa reacción».
Ahí apareció un componente del té verde «que tiene estas propiedades, interfiere ese proceso químico. Se administró a los hijos de los machos tratados previamente con los tóxicos, durante un período del desarrollo embrionario. Se ha comprobado que interfiere las reacciones químicas que hacen que las malformaciones se hereden, y las marcas epigenéticas vuelven al a normalidad. Los embriones se desarrollan también con normalidad, lo que confirma que el mecanismos que está detrás de esas malformaciones es el que hemos investigado. Todo eso deja la puerta abierta a detoxificar y luchar contra esas alteraciones del desarrollo».
Ese trabajo en los mecanismos de reparación es el que desarrolla actualmente el grupo de investigación. «Creo que puede tener muchas aplicaciones», concluye Paz Herráez.
